全球成千上萬人在與類風濕性關節炎(RA)[1]這個慢性自身免疫性疾病苦戰,而這場對抗頑疾的戰鬥正在多個方面進行。澳門科技大學黃錦偉教授團隊對RA展開深入研究,從揭開錯綜複雜的信號通路[2]、分子和細胞機制,再到探索創新的治療策略,這些研究成果為改善患者的治療效果和生活質量提供新的契機與曙光。
▲文章內圖
【分子和細胞機制】
研究團隊一直在深入探索這種疾病在分子和細胞層面的運作方式。其中一項研究發現了一種被用於對抗炎症的中藥單體化合物celastrol,它可以干擾關節細胞中的鈣平衡,導致自噬性細胞死亡和減輕關節炎症狀[3]。這一發現表明,干擾發炎細胞中的鈣平衡可能是應對關節炎的一種新方法。無獨有偶,研究人員還發現了一種名為Sirtuin 5(SIRT5)的長壽蛋白,它有助於調控體內的能量代謝和炎症反應[4],增加SIRT5的表達水平能夠顯著減輕類風濕性關節炎症狀。此外還有一項令人興奮的研究專注於特定基因突變,如p53腫瘤抑制基因突變體(p53R211*),它可以使免疫系統T-細胞冷靜下來並降低炎症,為類風濕性關節炎開辟了新的治療方向[5]。
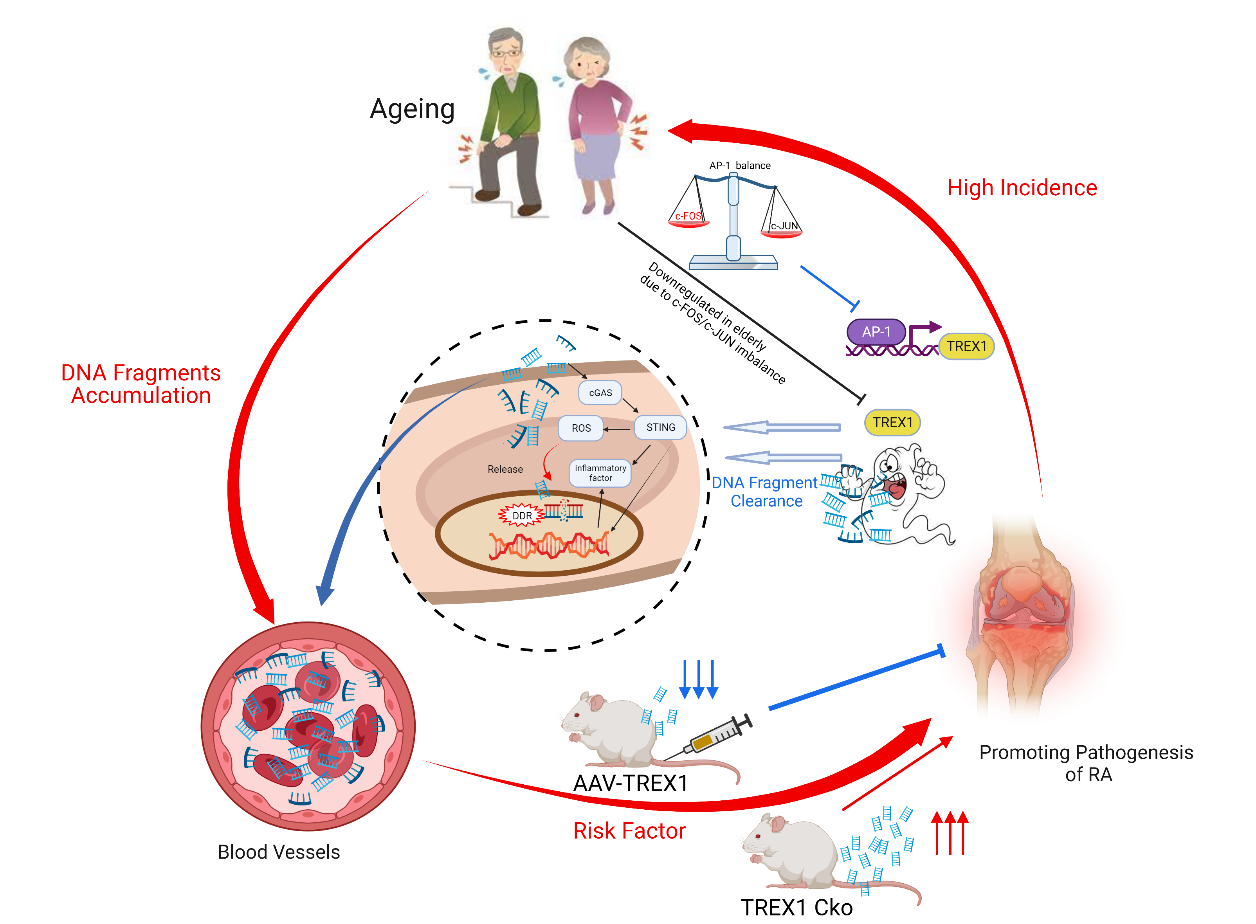
在探索治療方法方面,研究人員還在研究非編碼RNA的作用,這可能有助於早期診斷類風濕性關節炎並協助評估治療效果,為更個性化的護理和治療鋪平道路[6]。同時,研究人員發現清除積累的DNA碎片可能是預防風濕性關節炎進展的新方法[7]。這些突破性的發現都為了解和治療類風濕性關節炎開辟了新的途徑。
▲文章內圖
【治療方法和治療機制】
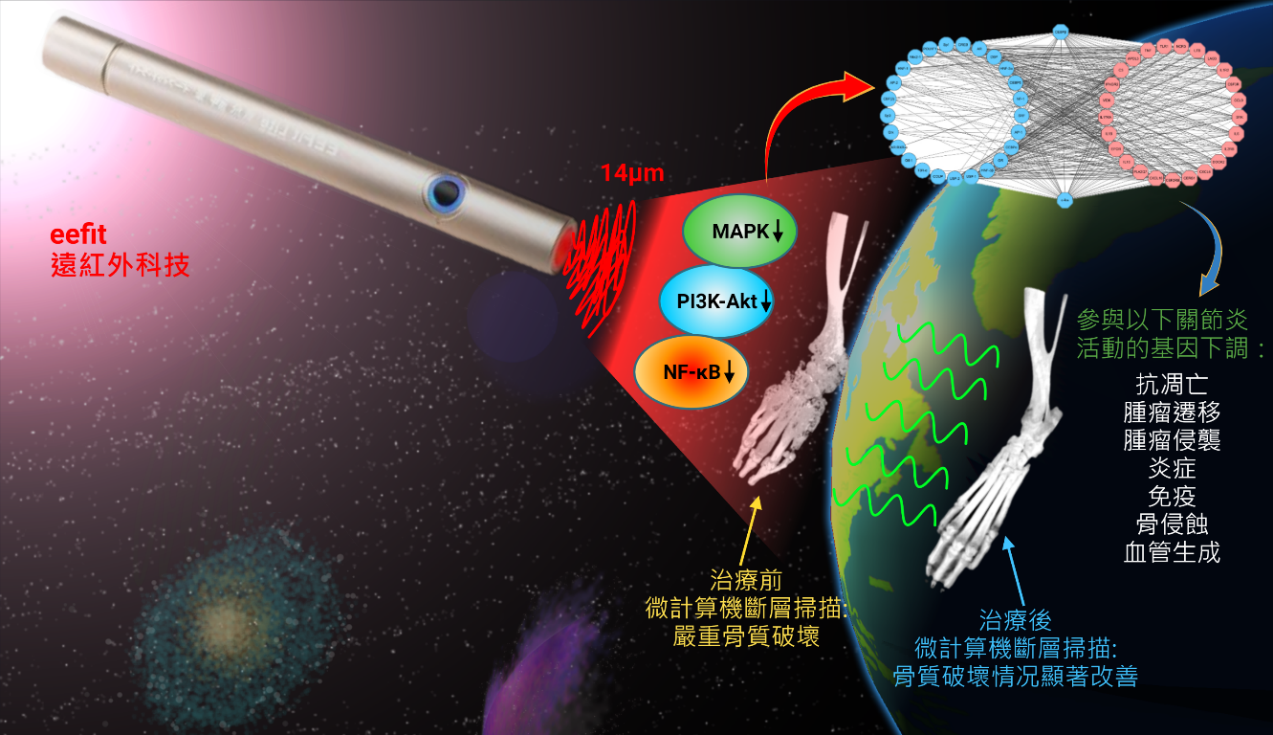
在探索創新的治療方法中,研究人員發現一個有前景的非藥物治療方法——遠紅外線輻射(FIR),它通過抑制該疾病的特定基因活性成功減緩了炎症[8]。此外,研究人員將epalrestat與抗氧化劑“N-乙醯半胱氨酸(NAC)”結合使用,這樣可以克服目前治療RA的一些缺點,如減輕毒性和炎症反應,因為單獨使用epalrestat可能會通過積聚有害物質而加重症狀[9]。
研究人員在對抗藥物耐藥性的研究上也取得了進展,他們發現 p53腫瘤抑制基因的突變可能使某些關節炎藥物的療效降低,這表明需要個體化的治療策略來改善患者的治療效果[10]。
無論是從揭開錯綜複雜的分子和細胞機制,或是探索創新的治療策略,團隊的研究人員都在持之以恆地努力著。這些研究成果不僅為類風濕性關節炎的治療開闢了新的道路,也為這種慢性疾病找到更有效的管理方法,讓受影響的 RA患者看到了希望。懷揣著這份初心,研究團隊將繼續堅定地在治癒類風濕性關節炎的道路上前進。

▲黃錦偉教授團隊
Reference:
[1] World Health Organization, “Rheumatoid arthritis,” https://www.who.int/news-room/fact-sheets/detail/rheumatoid-arthritis
[2] Q. Ding et al., “Signaling pathways in rheumatoid arthritis: implications for targeted therapy,” Sig Transduct Target Ther, vol. 8, no. 1, p. 68, Feb. 2023, doi: 10.1038/s41392-023-01331-9.
[3] V. K. W. Wong et al., “Ca2+ signalling plays a role in celastrol‐mediated suppression of synovial fibroblasts of rheumatoid arthritis patients and experimental arthritis in rats,” British J Pharmacology, vol. 176, no. 16, pp. 2922–2944, Aug. 2019, doi: 10.1111/bph.14718.
[4] N. Zhang et al., “Sirtuin 5 deficiency increases disease severity in rats with adjuvant-induced arthritis,” Cell Mol Immunol, vol. 17, no. 11, pp. 1190–1192, Nov. 2020, doi: 10.1038/s41423-020-0380-4.
[5] Y. Zeng et al., “Mutant p53R211* ameliorates inflammatory arthritis in AIA rats via inhibition of TBK1-IRF3 innate immune response,” Inflamm. Res., vol. 72, no. 12, pp. 2199–2219, Dec. 2023, doi: 10.1007/s00011-023-01809-w.
[6] J. Yang et al., “The role of non-coding RNAs (miRNA and lncRNA) in the clinical management of rheumatoid arthritis,” Pharmacological Research, vol. 186, p. 106549, Dec. 2022, doi: 10.1016/j.phrs.2022.106549.
[7] W.-D. Luo et al., “Age-related self-DNA accumulation may accelerate arthritis in rats and in human rheumatoid arthritis,” Nat Commun, vol. 14, no. 1, p. 4394, Jul. 2023, doi: 10.1038/s41467-023-40113-3.
[8] X. Chen et al., “Far infrared irradiation suppresses experimental arthritis in rats by down-regulation of genes involved inflammatory response and autoimmunity,” Journal of Advanced Research, vol. 38, pp. 107–118, May 2022, doi: 10.1016/j.jare.2021.08.015.
[9] L. Wang et al., “N -Acetylcysteine overcomes epalrestat-mediated increase of toxic 4-hydroxy-2-nonenal and potentiates the anti-arthritic effect of epalrestat in AIA model,” Int. J. Biol. Sci., vol. 19, no. 13, pp. 4082–4102, 2023, doi: 10.7150/ijbs.85028.
[10] C. Qiu et al., “The potential development of drug resistance in rheumatoid arthritis patients identified with p53 mutations,” Genes & Diseases, vol. 10, no. 6, pp. 2252–2255, Nov. 2023, doi: 10.1016/j.gendis.2023.02.007.





