澳科大侯盼盼科研团队在Cell Research发表文章
在心脏离子通道研究领域中取得新突破
澳门科技大学中药机制与质量全国重点实验室、埃尔文内尔生物物理与创新药物实验室侯盼盼助理教授科研团队近日在心脏离子通道研究领域取得新突破。
合作团队通过整合冷冻电镜与电生理技术,解析了心脏中关键的KCNQ1+KCNE1通道高分辨率结构,并提出由「二级结构转换,Secondary structure transitions」决定的独特门控机制。研究成果学术论文以澳科大为第一署名单位,于10月2日发表于国际权威期刊Cell Research(IF=25.9),题为:Secondary structure transitions and dual PIP2 binding define cardiac KCNQ1-KCNE1 channel gating。

心脏IKs钾通道由功能亚基KCNQ1和辅助亚基KCNE1组成,其介导的慢激活延迟整流钾电流是控制心脏动作电位复极化的关键电流之一,在运动、情绪激动等应激状态下的「战逃反应」中发挥重要作用。KCNQ1或KCNE1基因突变可引起长QT综合征(LQT1/LQT5),是青少年心源性猝死的主要遗传病因,占临床病例三分之一以上。
KCNE1的结合会重塑KCNQ1通道的特性,包括通道动力学(激活和去激活减慢、宏观电流和单通道电导增加、G-V曲线右移等)、离子通透性和药理特性。这些关键的生物物理特性改变,直接决定了IKs电流在心脏电生理中的特殊作用:其慢激活特性使其主要参与动作电位Phase 3复极化过程,从而对心率的调节具有独特意义。
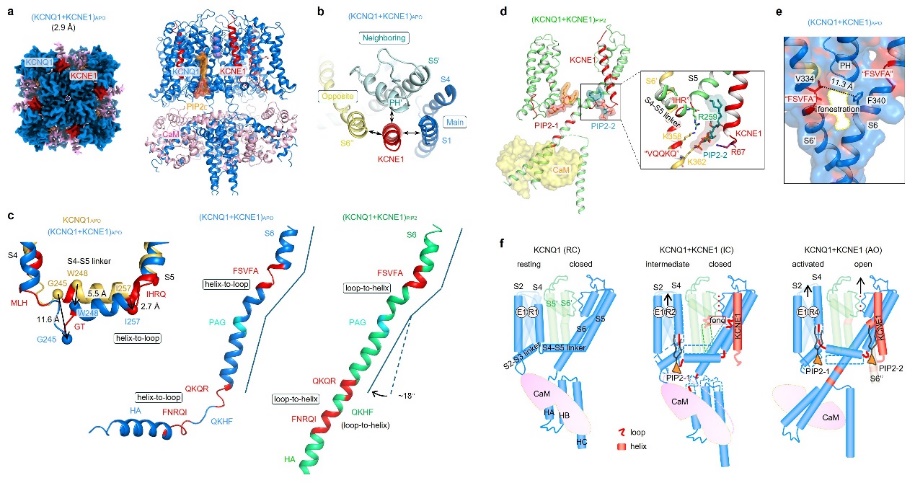
图1 二级结构转换与双PIP2结合定义心脏KCNQ1-KCNE1钾通道的门控
本研究系统阐明了KCNE1调控KCNQ1通道的结构基础及药理特性,取得了以下新发现:1)KCNE1结合在三个KCNQ1亚基交界处的关键位置,能够同时与通道的多个功能域相互作用,为其广泛调节通道的功能提供了结构依据(图1a,b)。2)KCNE1的结合引发通道发生大规模的二级结构转换(α螺旋与无序环状结构之间的转换),使原本相对刚性的α螺旋转变为更为柔软的无序结构。该转换在通道开关过程中频繁发生,导致IKs电流激活缓慢,从而特异性参与心脏Phase 3复极化过程(图1c)。3)本研究还发现IKs通道的开关受到两个PIP2分子的共同调控,其中一个在通道开关过程中稳定结合,另一个仅在开放态时与通道结合(图1d)。这一机制显著区别于仅受单个PIP2分子调控的KCNQ1及KCNQ1+KCNE3通道。4)本研究进一步发现IKs通道特有的「侧窗」药物结合口袋(图1e),为开发高特异性靶向该通道的新型药物提供了新思路。
这项研究结合结构解析与功能验证,首次发现了离子通道通过大规模的「二级结构转换」介导的门控新范式(图1f)。类似机制可能在HCN、BK、Nav、TRP等不同类型的通道中都普遍存在,参与调控多种门控特性和生理药理功能。
这项研究不仅深化了离子通道基础门控机制的理解,也为病理机制的阐明和创新治疗方案的开发奠定了坚实的基础。这项研究获得了澳门科技发展基金、国家自然科学基金、国家科技部与澳门科技发展基金联合项目、澳门科技大学研究基金的资助。

侯盼盼科研团队合影





